MATERIAL TÉCNICO:
¿Por qué se produce la condensación retrógrada?
¿Por qué se produce la condensación retrógrada?
por M. Crotti y S. Bosco
En esta página se realiza una exposición simple que no sólo permite comprender conceptualmente este fenómeno propio de los reservorios de gas y condensado, sino que es aplicable a muchas situaciones que involucran equilibrios de fases a altas presiones, tanto en estudios PVT de laboratorio como en condiciones de reservorio.
Resumidamente, la “anomalía” de la condensación retrógrada se manifiesta en:
- La condensación de líquido durante la expansión a temperatura constante de un gas (Donde el fenómeno “normal” es la condensación durante la compresión del gas).
- La condensación de líquido durante el calentamiento a presión constante de un gas (Donde el fenómeno “normal” es la condensación durante el enfriamiento del gas).
Para introducir estos fenómenos no vamos a recurrir a los diagramas PT (donde la demostración es clara pero algunos conceptos físicos pueden quedar ocultos). En realidad vamos a tratar de emplear al sentido común para mostrar que la condensación retrógrada es un proceso “normal”.
Cuando hay dos fases fluidas en un sistema, es muy fácil decidir cuál es el líquido y cuál es el gas: La fase superior corresponde al gas y la inferior al líquido. La diferencia más notable entre un gas y un líquido es la densidad. Y la densidad está ligada a la distancia que separa las moléculas. Si las moléculas están muy distanciadas (como suele ocurrir en el estado gaseoso) la densidad es baja.
Pero las moléculas se acercan entre sí por dos razones.
- A bajas temperaturas porque la agitación térmica no logra contrarrestar las fuerzas de atracción entre moléculas (Fuerzas de Van der Waals) y se produce la condensación “normal” (formación de líquidos por enfriamiento).
- A altas presiones. Entregando alta energía al sistema para “obligar” a las moléculas a permanecer en contacto pese a la agitación térmica.
De este modo tanto en los líquidos como en los gases a alta presión, las densidades son altas. Y esto hace que los gases a alta presión tengan un comportamientos similar al de los líquidos.
Y por esta misma razón los gases a alta presión son capaces de “disolver” líquidos. La disolución implica la mezcla íntima de las moléculas. Es difícil imaginar la “disolución” de un líquido en un gas a presión atmosférica pues en el mismo volumen en que el gas tiene apenas 1 molécula, una fase líquida puede contener cientos de moléculas.
Pero en los gases a muy alta presión (200 ó más Kg/cm2) las distancias moleculares se acortan de tal manera que es perfectamente razonable aceptar que una fase gaseosa en esas condiciones puede disolver moléculas más pesadas (el gas y el líquido pasan a tener cantidades similares de moléculas por unidad de volumen).
Entonces ¿qué ocurre si (luego de disolver algo de líquido), un gas a alta presión se expande?
Respuesta: Pierde su capacidad de disolver líquidos (pasa a comportarse como un gas con las moléculas distanciadas) y los componentes pesados se desprenden generando lo que se conoce como condensación retrógrada, que es perfectamente “normal”.
Y lo mismo pasa cuando un gas a alta presión se calienta (en forma isobárica). La expansión térmica aleja las moléculas del gas y los componentes pesados se desprenden de la masa gaseosa.
La explicación es sencilla, pero el problema subyacente es otro. Como mencionamos en otros desarrollos, los que trabajamos con petróleo y gas natural estamos acostumbrados a calificar las mezclas no por lo que son, sino por lo que va a ocurrir con ellas. En este caso (condensación retrógrada) calificamos de gas a la mezcla inicial homogénea, porque a partir de ella, mediante un proceso común en la producción de los reservorios, se empieza a desprender un líquido.
Qué otra cosa puede ser una mezcla de la cual se desprenden gotas más densas que el fluido original?.
La respuesta puede ser sorprendente, pero para ello es conveniente emplear los diagramas de fases :
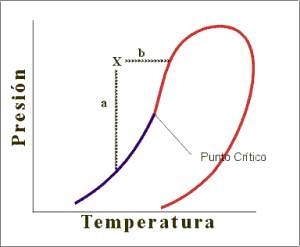
Figura 1: Dos caminos termodinámicos para la misma mezcla.
Partiendo de una mezcla representada por el punto “X” en la figura 1, podemos estudiar su comportamiento mientras se la somete a una despresurización isotérmica (camino “a”) o un calentamiento isobárico (camino “b”):
- Camino “a”. Es el camino termodinámico típico de los estudios PVT para fluidos de reservorios sometidos a depletación. En este caso diríamos que nos encontramos frente a un petróleo muy subsaturado. Cuando la presión desciende lo suficiente se comienza a liberar gas en el seno del fluido, dado que se “corta” la campana por la curva de presiones de burbuja (Trazo azul).
- Camino “b”. Es un camino termodinámico perfectamente válido, pero infrecuente en la industria del petróleo, donde los procesos de reservorio transcurren (generalmente) a temperatura constante. Lo interesante de este camino es que cuando la temperatura sube lo suficiente, del seno de la muestra comienza a liberarse líquido (se “corta” la campana por la curva de presiones de rocío representada con trazo rojo). De este modo calificaríamos a la mezcla en el punto “X” como gas.
Y cómo es posible que a la misma mezcla, en idénticas condiciones de Presión y Temperatura, la califiquemos como Petróleo o como Gas, dependiendo del proceso a que la sometemos?.
Sencillamente porque calificamos a la mezcla por lo que vamos a hacer con ella y no por lo que es.
Y, entonces, ¿la mezcla “X” es gaseosa o líquida?.
Ni una cosa ni la otra. Es un fluido monofásico.
Como ya mencionamos, los términos Gas o Líquido es conveniente (y muchas veces necesario) guardarlos sólo para calificar las fases cuando coexisten. En los sistemas bifásicos fluidos, el gas es la fase superior y el liquido es la fase inferior. En los sistemas monofásicos es conveniente hablar de fluidos monofásicos y evitar prejuicios que pueden conducir a serios errores conceptuales y prácticos.
En la industria del petróleo, el uso poco cuidadoso de los términos Gas y Liquido muchas veces resulta aceptable porque el camino termodinámico suele estar prefijado. Pero incluso en estos casos es conveniente estar prevenido pues cuando cambian los sistemas de explotación o tratamiento, pueden cambiar los supuestos básicos de estudio.
